
Nos projets pré-cliniques et cliniques ont pour objectif de fournir une caractérisation métabolique in vivo des PPGL en relation avec leurs altérations génétiques grâce à des approches d’imagerie par spectroscopie de résonance magnétique et de traçage métabolique au 13C-Glucose.
La spectroscopie par résonance magnétique du proton (1H-MRS) est une séquence particulière d’imagerie par résonnance magnétique permettant l’identification de métabolites spécifiques en lien avec les mutations retrouvées dans les PPGL.
En particulier, chez les patients porteurs d’un PPGL lié à une mutation sur un gène SDHx, on observe une perte de fonction complète de la succinate déshydrogénase (SDH, une enzyme du cycle TCA qui oxyde le succinate en fumarate) avec pour conséquence une accumulation massive de succinate dans la tumeur. Nous avons précédemment utilisé la 1H-MRS pour identifier le succinate dans les tumeurs PPGL in vivo et avons démontré que ce métabolite est un biomarqueur non invasif et spécifique des mutations SDHx. Grâce à cette même technique nous avons également pu mettre en évidence un lien de causalité indiscutable entre le développement d’adénome hypophysaire et la présence d’une mutation SDH)
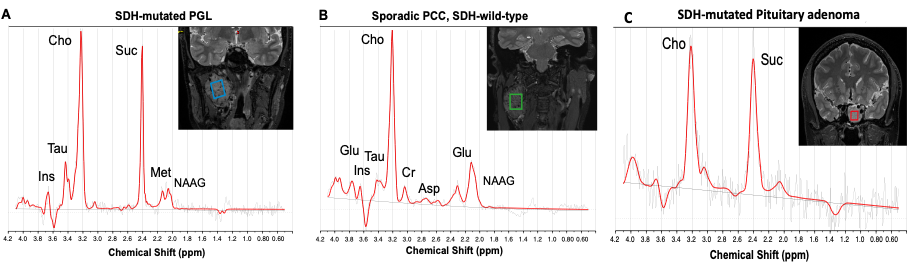
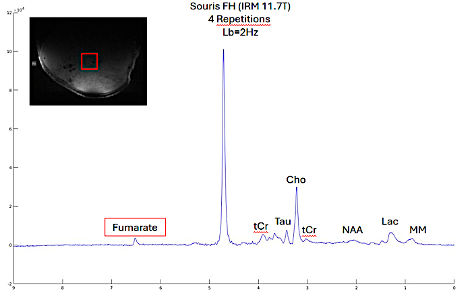
Notre hypothèse est que la plupart des mutations génétiques prédisposant aux PPGL ont un impact sur le métabolisme avec un profil métabolique spécifique détectable par 1H-MRS. Pour cela nous étudions actuellement sur l’IRM 11,7T petit animal du CENIR (Center for Neuroimaging Research – Paris Brain Institute) les profils métaboliques spécifiques associés à 4 gènes mutés (Sdhb, Scl25a11, Fh et Vhl) dans des modèles d’allogreffes de souris. Une accumulation de fumarate a déjà pu être observée dans le modèle d’allogreffe avec mutation Fh
Nous avons également pour projet le développement d’un test diagnostic spécifique des mutations SDHx permettant l’identification rapide des patients par une approche d’analyse des flux métaboliques basée sur l’utilisation d’un isotopomère stable du glucose (13C-Glucose). Nous avons récemment démontré sur un modèle cellulaire que les cellules déficientes pour le gène Sdhb présentaient un « switch » métabolique important conduisant notamment à la production spécifique d’un isotopomère de l’aspartate. L’hypothèse de notre recherche translationnelle est que ce déficit majeur du métabolisme du glucose est présent chez les patients ayant un PPGL avec mutation SDHx. Ainsi, en utilisant la même approche de flux métabolique, l’administration intraveineuse (IV) d’une dose unique de 13C6-glucose nous permettrait d’identifier très rapidement et de façon simple la présence d’une mutation SDHx chez un patient porteur de PPGL. Ce projet est en cours d’obtention des autorisations tecnico-réglementaires

