Physiopathologies des maladies oculaires : innovations thérapeutiques

Responsable d'équipe :
Francine Behar-Cohen

Adjoint.e :
Alicia Torriglia
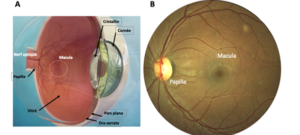
L’œil est constitué de tissus transparents qui permettent la bonne transmission des photons vers les photorécepteurs qui convertissent les photons en signaux électriques vers le cerveau. Comme le cerveau, l’œil est protégé par des barrières qui empêchent les médicaments systémiques d’atteindre les tissus oculaires.
Quelle que soit la cause primitive de la maladie, la vision est perdue par des mécanismes communs majeurs conduisant à la perte de transparence des tissus, à la mort des cellules visuelles et à des réactions tissulaires anormales telles que l’inflammation, la fibrose et la néovascularisation.
Les objectifs de notre équipe sont d’identifier des cibles moléculaires régulatrices clés impliquées dans la pathogenèse des principaux mécanismes responsables de la perte de vision, accessibles à la modulation par des médicaments, administrés localement, et applicables à des maladies d’origines diverses. Nous développons une recherche translationnelle afin de répondre au nécessaire besoin de thérapies médicales innovantes.
Les questions scientifiques qui sous-tendent nos travaux émergent de problèmes cliniques. Nous analysons également les mécanismes d’action des médicaments couramment utilisés en ophtalmologie ( par ex anti-VEGF et corticoïdes), ainsi que les risques oculaires liés à l’exposition aux modifications environnementales (exposition à la lumière, perturbateurs endocriniens).
Les recherches menées par notre équipe comblent le fossé entre la découverte et la preuve de concept chez l’homme.
La valorisation est envisagée pour permettre des développements ultérieurs des recherches menées par l’équipe.
Mots clés : œil, rétine, administration de médicaments oculaires, œdème maculaire, stress oxydatif, lumière, corticostéroïdes, ROCK kinase, SUR1, neuroprotection, innovation thérapeutique, biomarqueurs.
Thèmes scientifiques
Mécanismes de régulation de la transparence des tissus
Nous développons des thérapies ciblées visant à restaurer l'intégrité des tissus et la qualité optique, en particulier pour la perte de transparence de la cornée ou de la rétine associée à diverses maladies.
Neuroprotection
Nous développons des traitements qui limitent les conséquences délétères du stress oxydatif, induit par le fer, ischémique, radique, métabolique et excitotoxique.
Biomarqueurs et administration de médicaments
Afin de progresser vers des essais thérapeutiques, il est essentiel de sélectionner les patients susceptibles de répondre aux différents traitements développés sur la base de biomarqueurs d'activité des voies ciblées, de définir des biomarqueurs d'efficacité et de développer des méthodes de ciblage local des médicaments.
Principales publications
Conseil scientifique : AVIS et RAPPORT relatif à la Crédibilité de l’expertise scientifique link
Congenital aniridia beyond black eyes: From phenotype and novel genetic mechanisms to innovative therapeutic approaches. Daruich A, Duncan M, Robert MP, Lagali N, Semina EV, Aberdam D, Ferrari S, Romano V, des Roziers CB, Benkortebi R, De Vergnes N, Polak M, Chiambaretta F, Nischal KK, Behar-Cohen F, Valleix S, Bremond-Gignac D.Prog Retin Eye Res. 2023 Jul;95:101133. link
Single mRNA detection of Wnt signaling pathway in the human limbus. Bonnet C, Ruiz M, Gonzalez S, Tseng CH, Bourges JL, Behar-Cohen F, Deng SX. Exp Eye Res. 2023 Apr;229:109337. doi: 10.1016/j.exer.2022.109337. Epub 2023 Jan 23. PMID: 36702232 Free article. link
Optical Coherence Tomography Angiography Assessment in Congenital Aniridia. Dentel A, Ferrari M, Robert MP, Valleix S, Bremond-Gignac D, Daruich A. Am J Ophthalmol. 2023 Apr 13;253:44-48. link
High Levels of C-Reactive Protein with Low Levels of Pentraxin 3 as Biomarkers for Central Serous Chorioretinopathy. Bousquet E, Chenevier-Gobeaux C, Jaworski T, Torres-Villaros H, Zola M, Mantel I, Kowalczuk L, Matet A, Daruich A, Zhao M, Yzer S, Behar-Cohen F. Ophthalmol Sci. 2023 Feb 3;3(3):100278. doi: 10.1016/j.xops.2023.100278. eCollection 2023 Sep. PMID: 36950301 Free PMC article. link
A mathematical model of wound healing in bovine corneal endothelium. Hernández JA, Chifflet S, Justet C, Torriglia A. J Theor Biol. 2023 Feb 21;559:111374. link
Early treatment of neonatal diabetes with oral glibenclamide in an extremely preterm infant. Galderisi A, Kermorvant-Duchemin E, Daruich A, Bonnard AA, Lapillonne A, Aubelle MS, Perrella B, Vial Y, Cave H, Berdugo M, Jarreau PH, Polak M, Beltrand J. JIMD Rep. 2023 Jan 29;64(2):161-166. link
Retinoblastoma: From genes to patient care. Bouchoucha Y, Matet A, Berger A, Carcaboso AM, Gerrish A, Moll A, Jenkinson H, Ketteler P, Dorsman JC, Chantada G, Beck-Popovic M, Munier F, Aerts I, Doz F, Golmard L; European Retinoblastoma Group EuRbG. Eur J Med Genet. 2023 Jan;66(1):104674 link
In Vivo Retinal Pigment Epithelium Imaging using Transscleral Optical Imaging in Healthy Eyes. Kowalczuk L, Dornier R, Kunzi M, Iskandar A, Misutkova Z, Gryczka A, Navarro A, Jeunet F, Mantel I, Behar-Cohen F, Laforest T, Moser C. Ophthalmol Sci. 2022 Oct 19;3(1):100234. doi: 10.1016/j.xops.2022.100234. eCollection 2023 Mar. PMID: 36545259 link
Ophthalmological Impairments at Five and a Half Years after Preterm Birth: EPIPAGE-2 Cohort Study. Chapron T, Pierrat V, Caputo G, Letouzey M, Kermorvant-Duchemin E, Abdelmassih Y, Beaumont W, Barjol A, Le Meur G, Benhamou V, Marchand-Martin L, Ancel PY, Torchin H. J Clin Med. 2022 Apr 11;11(8):2139. link
Venous overload choroidopathy: A hypothetical framework for central serous chorioretinopathy and allied disorders. Spaide RF, Gemmy Cheung CM, Matsumoto H, Kishi S, Boon CJF, van Dijk EHC, Mauget-Faysse M, Behar-Cohen F, Hartnett ME, Sivaprasad S, Iida T, Brown DM, Chhablani J, Maloca PM. Prog Retin Eye Res. 2022 Jan;86:100973. link
Oral Ursodeoxycholic Acid Crosses the Blood Retinal Barrier in Patients with Retinal Detachment and Protects Against Retinal Degeneration in an Ex Vivo Model Alejandra Daruich, Thara Jaworski, Hugues Henry, Marta Zola, Jenny Youale, Léa Parenti, Marie-Christine Naud, Kimberley Delaunay, Mathilde Bertrand, Marianne Berdugo, Laura Kowalczuk, Jeffrey Boatright, Emilie Picard & Francine Behar-Cohen. Neurotherapeutics 2021. Apr;18(2):1325-1338. doi: 10.1007/s13311-021-01009-6. link
Retinal phototoxicity and the evaluation of the blue light hazard of a new solid-state lighting technology. Jaadane I, Villalpando Rodriguez G, Boulenguez P, Carré S, Dassieni I, Lebon C, Chahory S, Behar-Cohen F, Martinsons C, Torriglia A. Sci Rep. 2020 Apr 21;10(1):6733. link
The antidiabetic drug glibenclamide exerts direct retinal neuroprotection. Berdugo M, Delaunay K, Naud MC, Guegan J, Moulin A, Savoldelli M, Picard E, Radet L, Jonet L, Djerada Z, Gozalo C, Daruich A, Beltrand J, Jeanny JC, Kermorvant-Duchemin E, Crisanti P, Polak M, Behar-Cohen F. Transl Res. 2020 Oct 17:S1931-5244(20)30244-9. doi: 10.1016/j.trsl.2020.10.003. link
Transscleral Optical Phase Imaging of the Human Retina. Laforest T, Künzi M, Kowalczuk L, Carpentras D, Behar-Cohen F, Moser C.Nat Photonics. 2020 Jul;14(7):439-445. doi: 10.1038/s41566-020-0608 link
Iron is neurotoxic in retinal detachment and transferrin confers neuroprotection. Daruich A, Le Rouzic Q, Jonet L, Naud MC, Kowalczuk L, Pournaras JA, Boatright JH, Thomas A, Turck N, Moulin A, Behar-Cohen F, Picard E. Sci Adv. 2019 Jan 9;5(1):eaau9940. link
Mineralocorticoid receptor antagonism limits experimental choroidalneovascularization and structural changes associated with neovascular age-related macular degeneration. Zhao, M., et al., Nat Commun, 2019. 10(1): p. 369. link
Toutes les publicationsMembres de l'équipe
Chercheurs
Enseignants-Chercheurs
Hospitaliers/Hospitalo-universitaires
ITA/ITRF/BIATSS
Post-Doctorants












