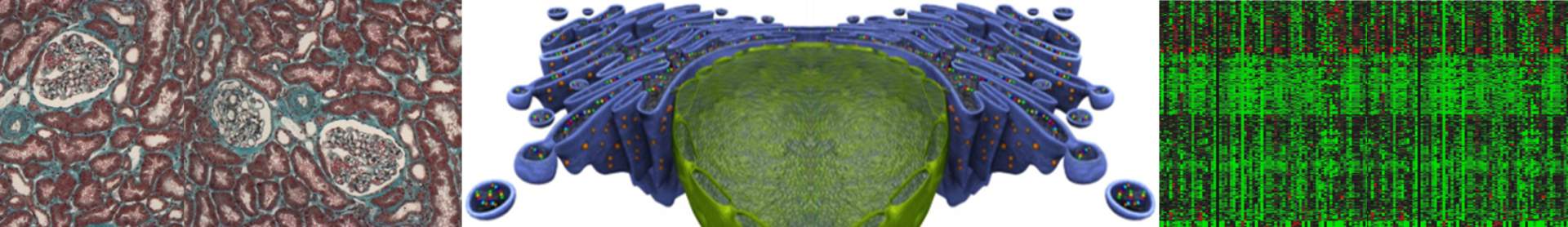
L’insuffisance rénale terminale (IRT) est un état pathologique résultant d’une maladie rénale chronique (MRC), qui touche des millions de personnes dans le monde et constitue un problème de santé publique et un défi économique majeur. Malgré des progrès considérables, il reste de nombreux défis à relever en ce qui concerne les mécanismes, la prévention et la guérison de l’IRC, avec des conséquences immédiates pour les patients en termes de mortalité, de morbidité et de coût pour la société. Le domaine de la médecine rénale doit améliorer les connaissances actuelles sur les processus moléculaires qui sont essentiels à l’établissement et à la progression de la maladie rénale, et accélérer la traduction des découvertes en science fondamentale dans le domaine clinique en termes de diagnostic précoce et de stratégies thérapeutiques. Nous sommes prêts à fournir des informations mécanistes sur la manière dont le rein lésé active les réponses adaptatives au stress au niveau cellulaire qui conduiraient à la maladie rénale chronique, des modèles cellulaires in vitro aux modèles murins génétiquement modifiés, en transférant leurs conséquences cliniques à de grandes cohortes humaines prospectives.
Les lésions rénales aiguës sont associées à des altérations du micro-environnement et à des perturbations de l’homéostasie, ce qui oblige les cellules à activer des processus biologiques conduisant à une profonde reprogrammation métabolique, qui favorise la survie des cellules dans le milieu lésé et élimine les facteurs de stress. À son tour, la maladie reflète l’incapacité des réponses adaptatives à restaurer l’homéostasie tissulaire. Les reins doivent faire face à un large éventail d’agressions qui se traduisent par des facteurs de stress élémentaires au niveau cellulaire (par exemple, la privation de nutriments, l’hypoxie, le stress oxydatif, le stress inflammatoire et les perturbations de la protéostase). Les réponses adaptatives à ces stress sont souvent des systèmes moléculaires conservés au cours de l’évolution qui visent principalement à éradiquer ou à réduire l’intensité du stress et à promouvoir la reprogrammation métabolique pour maintenir l’homéostasie cellulaire et d’autres fonctions vitales.
Les modules moléculaires détectent les fluctuations micro environnementales des nutriments, de l’oxygène et de la température, ainsi que les fluctuations intracellulaires désordonnées, telles que l’accumulation de protéines non pliées et la pénurie d’énergie (ATP), entre autres. Ces modules transmettent ensuite des signaux qui alimenteront la reprogrammation métabolique afin de maintenir les fonctions de base, tout en adaptant la cellule aux nouvelles conditions environnementales. Outre les décisions cellulaires de vie ou de mort, ces réponses adaptatives participent également à la construction de réseaux de communication qui façonnent le microenvironnement cellulaire stressé, généralement de manière paracrine, conduisant à l’activation de réponses préventives dans les cellules qui n’ont pas encore été soumises au stress et à la production de signaux d’alarme. Par conséquent, les voies de réponses adaptatives au stress sont probablement essentielles pour le remodelage tissulaire, car elles façonnent l’équilibre endogène de réparation et de cicatrisation dans les tissus et ont donc un impact significatif sur les résultats fonctionnels du rein lésé, conduisant finalement à l’IRC. En outre, ces circuits de reprogrammation moléculaire et ces réponses adaptatives cellulaires interviennent très tôt après le début de l’insuffisance rénale aiguë, bien avant la mort cellulaire et le déclenchement du processus de réparation inadapté. La détection de leur activation constitue donc une opportunité de diagnostic précoce des lésions tissulaires en cours.

Par conséquent, la caractérisation des mécanismes moléculaires qui sous-tendent les réponses cellulaires au stress aigu et leurs conséquences structurelles et fonctionnelles au niveau des tissus est cruciale pour le développement de stratégies préventives et thérapeutiques en médecine rénale. Il est désormais clairement établi que le stress du RE ou certaines parties de l’UPR qui, par exemple, ciblent les cellules épithéliales, participent activement au développement de l’insuffisance rénale aiguë et de la maladie rénale chronique, et nous développons actuellement un programme de recherche visant à démontrer que l’UPR, engagé lors d’une lésion tissulaire aiguë, est essentiel pour le remodelage des tissus et a donc un impact significatif sur les résultats fonctionnels du rein lésé.
En résumé, nos projets ont pour but de combler le fossé entre la science fondamentale et la recherche biomédicale appliquée et de fournir aux cliniciens des outils accessibles pour la prédiction précoce de l’évolution de la maladie rénale chronique, leur offrant ainsi la possibilité de mieux personnaliser la gestion clinique et le traitement.
Publications :
Taurine Deficiency Is a Hallmark of Injured Kidney Allografts. A. Rinaldi, P. E. Cippà, I. Nemazanyy, D. Anglicheau, N. Pallet. Transplantation, 2024, Vol. 108 pp. e218–e228 Link.
STAT3 Drives the Expression of ACSL4 in Acute Kidney Injury. V. Poindessous, H. Lazareth, G. Crambert, L. Cheval, J. L. Sampaio, N. Pallet. iScience, 2024, Vol. 27 pp. 109737 Link.
Lipidomic Profiling of Kidney Cortical Tubule Segments Identifies Lipotypes with Physiological Implications. L. Cheval, V. Poindessous, J. L. Sampaio, G. Crambert, N. Pallet. Function (Oxford, England), 2024, Vol. 5 pp. zqae016 Link.
Impaired Fatty Acid Metabolism Perpetuates Lipotoxicity along the Transition to Chronic Kidney Injury. A. Rinaldi, H. Lazareth, V. Poindessous, I. Nemazanyy, J. L. Sampaio, D. Malpetti, Y. Bignon, M. Naesens, M. Rabant, D. Anglicheau, P. E. Cippà, N. Pallet. JCI insight, 2022, Vol. 7 pp. e161783 Link.
Validation of a Liquid Chromatography Coupled to Tandem Mass Spectrometry Method for Simultaneous Quantification of Tryptophan and 10 Key Metabolites of the Kynurenine Pathway in Plasma and Urine: Application to a Cohort of Acute Kidney Injury Patients. Z. Nadour, C. Simian, O. Laprévote, M.-A. Loriot, I. A. Larabi, N. Pallet. Clinica Chimica Acta; International Journal of Clinical Chemistry, 2022, Vol. 534 pp. 115–127 Link.
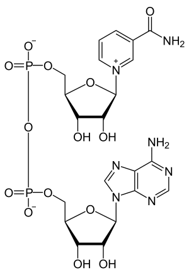
Cell Stress Response Impairs de Novo NAD+ Biosynthesis in the Kidney. Y. Bignon, A. Rinaldi, Z. Nadour, V. Poindessous, I. Nemazanyy, O. Lenoir, B. Fohlen, P. Weill-Raynal, A. Hertig, A. Karras, P. Galichon, M. Naesens, D. Anglicheau, P. E. Cippà, N. Pallet. JCI insight, 2022, Vol. 7 pp. e153019 Link.