*La leucémie lymphoïde chronique (LLC), forme de leucémie chronique la plus courante dans les pays occidentaux, est caractérisée par une prolifération clonale et l’accumulation de lymphocytes B matures CD5+CD23+ dans la moelle osseuse, le sang périphérique et les tissus lymphoïdes. Du point de vue clinique et biologique la LLC est une maladie très hétérogène, pour laquelle certains patients n’ont jamais besoin de traitement, alors que d’autres présentent une évolution agressive avec une mauvaise réponse au traitement et le décès en quelques mois. La LLC peut évoluer vers un lymphome agressif appelé syndrome de Richter, chez 2 à 9 % des patients et jusqu’à 20 % des cas réfractaires. Jusqu’à ces dernières années, le traitement reposait principalement sur l’immunochimiothérapie : association de fludarabine, de cyclophosphamide et de l’anticorps anti-CD20 rituximab (FCR) ou bendamustine-rituximab. L’introduction et l’approbation de nouveaux médicaments à ciblage moléculaire ont fourni des options de traitement supplémentaires pour les patients atteints de LLC. Parmi eux, les inhibiteurs de Bruton Tyrosine Kinase (BTKi), qui répriment la signalisation du récepteur des cellules B (BCR), et les antagonistes de la protéine anti-apoptotique BCL-2, tel que le vénétoclax, sont les traitements ciblés les plus largement utilisés. Ces nouveaux agents ont démontré une efficacité clinique importante, y compris chez les patients à haut risque. Cependant, malgré ces progrès thérapeutiques récents, la LLC reste une maladie incurable, avec des rechutes et des patients développant une résistance aux traitements. Ainsi, la recherche de nouvelles opportunités thérapeutiques reste une question d’actualité. Notre équipe contribue à ce défi en visant à une meilleure compréhension de la physiopathologie de cette maladie, à travers trois approches complémentaires :
(i) Formes agressives de LLC (F Nguyen-Khac, E Chapiro).
Notre équipe analyse en profondeur trois anomalies chromosomiques encore peu explorées associées à l’agressivité, au mauvais pronostic et à la résistance aux thérapies ciblées anti-LLC (ex. BTKi) : (1) gain du bras court (p) du chromosome 2 (Kostopoulou et al ., Cancer Med. 2019 ; Cosson et al., Leukemia 2017 ; Chapiro et al., Leuk Res. 2010 ); (2) délétion 8p (Jondreville et al., Leukemia 2023) et (3) anomalies du gène MYC (localisé sur le bras long du chromosome 8)(translocations et gains ; Chapiro et al., Blood 2019). La pertinence de ces anomalies dans la physiopathologie de la LLC et la résistance aux médicaments est actuellement analysée : (i) dans des modèles de lignées cellulaires spécifiques modifiées par CRISPR/Cas9 qui miment ces anomalies (déjà disponibles dans notre laboratoire) ; (ii) dans les cellules primaires de LLC en analysant les plus grandes cohortes mondiales pour chacune de ces trois aberrations (cohorte TEACLL) ; et (iii) en comparant la survie et la réponse au traitement des patients inclus dans la cohorte TEACLL avec une cohorte témoin de LLC. Des techniques de biologie cellulaire et moléculaire, de cartographie optique du génome, de transcriptomique, de RNASeq single-cell et d’approches bio-informatiques sont utilisées dans ce contexte.

(ii) Rôle du BCR dans la pathogenèse de la LLC (F Davi, M Armand, C Bravetti).
L’étude des récepteurs antigéniques à la surface des lymphocytes, en particulier le récepteur des cellules B (BCR), est une des thématiques centrales de notre groupe. D’une part, les recombinaisons génétiques complexes (réarrangements VDJ) nécessaires à leur formation constituent des marqueurs moléculaires uniques pour chaque lymphocyte, très utiles pour le diagnostic et le suivi des tumeurs lymphoïdes. Il devient également de plus en plus clair que le BCR joue un rôle essentiel dans la pathogenèse de nombreux troubles lymphoprolifératifs à cellules B.
Au cours des dernières années, notre équipe a développé des méthodes d’analyse des BCR par séquençage à haut débit (HTS), au sein d’un projet collaboratif européen (EuroClonality) (Langlois de Septenville A et al, Methods Mol Biol. 2022 et Davi F et al, Leukemia .2020). Nous visons maintenant à : (i) analyser les gènes des chaînes légères, car certains d’entre eux pourraient avoir un intérêt pronostique dans la LLC ; (ii) séquencer de longs fragments d’ADN à l’aide de la technologie Nanopore (collaboration avec J. Strefford, Royaume-Uni), pour détecter les anomalies moléculaires en aval des régions variables d’Ig ; (iii) évaluer l’étendue et l’impact de la diversité intraclonale des gènes d’Ig sur l’évolution de la maladie et la réponse au traitement. En collaboration avec l’équipe de J. Bernardes (Sorbonne Université), nous avons créé le progiciel ViCloD, permettant une visualisation et une analyse rapides et simples de la diversité intraclonale des BCR issus du processus d’hypermutations somatiques (HMS) (Jeusset L et al. , NAR Genom Bioinform.2023). Nous poursuivrons nos efforts pour implémenter ce logiciel avec de nouvelles fonctionnalités (caractéristiques moléculaires des HMS, études longitudinales, etc.), dont certaines feront appel à l’intelligence artificielle.

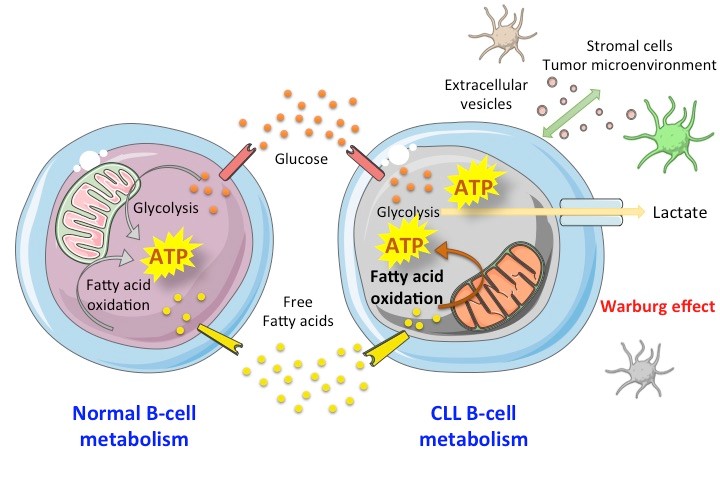
(iii) Reprogrammation métabolique dans la LLC (SA Susin, D Garnier).
Les études sur le métabolisme des cellules cancéreuses ont connu une renaissance récente avec la reconnaissance d’un métabolisme altéré comme élément essentiel du phénotype tumoral. Ainsi, les études sur le métabolisme tumoral ont reçu un intérêt notable ces dernières années et l’analyse de la reprogrammation métabolique a mis en évidence des vulnérabilités des cellules tumorales, conduisant au développement d’approches thérapeutiques anticancéreuses combinées.
(a) Notre laboratoire a récemment montré que le métabolisme des acides gras alimente l’OXPHOS mitochondriale dans les cellules B de la LLC et que son inhibition entraîne des altérations mitochondriales et la mort cellulaire. Plus précisément, la voie d’oxydation des acides gras peroxysomaux (pFAO) (une voie métabolique mal comprise) semble jouer un rôle essentiel dans l’alimentation de l’OXPHOS mitochondriale dans la LLC (Tannoury et al. Leukemia, 2023 sous presse). Suite à ces résultats, cette partie de notre programme de recherche vise à analyser : (i) la voie métabolique de la pFAO dans un panel plus large de cellules B de LLC, incluant des cellules de patients réfractaires ou en rechute ; (ii) si la modulation pharmacologique de la FAO, seule ou en association avec des médicaments anti-LLC, pourrait être utilisée comme thérapie pour éliminer les cellules LLC résistantes aux médicaments ou en rechute ; (iii) la spécificité d’une telle thérapie (par exemple, si la thérapie métabolique cible les cellules tumorales tout en épargnant les cellules immunitaires non tumorales) ; et (iv) le potentiel in vivo d’une thérapie métabolique pFAO.
(b) Les interactions bidirectionnelles entre les cellules B leucémiques et les cellules non transformées, y compris les cellules stromales, peuvent conduire à l’établissement d’un microenvironnement immunosuppresseur favorisant la résistance à la LLC. Récemment, l’échange de vésicules extracellulaires (VE) a été proposé comme nouveau moyen de communication (Dubois K et al., Cancers 2023). Les VE sont composées d’exosomes (30 à 150 nm) et de microparticules (150 nm à 1 μm), qui ont un impact sur les processus physiopathologiques et contiennent des profils sélectifs de microARN, de protéines ou d’ADN, qui peuvent être transférés dans les cellules cibles. Nous avons récemment démontré que dans les cellules de patients atteints de LLC, les VE stromales compensent la toxicité induite par le blocage de l’entrée du glucose, suggérant une reprogrammation métabolique vers la glycolyse. En utilisant des approches de métabolomique, fluxomique et transcriptomique, couplées à de la bio-informatique, notre objectif est maintenant de clarifier les modalités de cette coopération stroma-LLC médiée par les VE, avec un intérêt particulier pour l’hypothèse d’une régulation épigénétique.